사노피, 고령 독감 백신 허가… MSD, 전립선암약 3상
사노피, 고령 독감 백신 허가… MSD, 전립선암약 3상
[허가/임상] 사노피, 고령 독감 백신 허가… MSD, 전립선암약 3상
- 기자명
황재선 기자
입력 2023.12.04 06:01
사노피 '에플루엘다', 65세 이상 고연령자 투여 가능한 4가 백신
2023년 성인 예방접종 개정안, 에플루엘다 등 3개 제제 투여 권고
MSD, 작년 7월부터 '오리온코퍼레이션'과 개발 중인 'MK-5684' 3상 승인
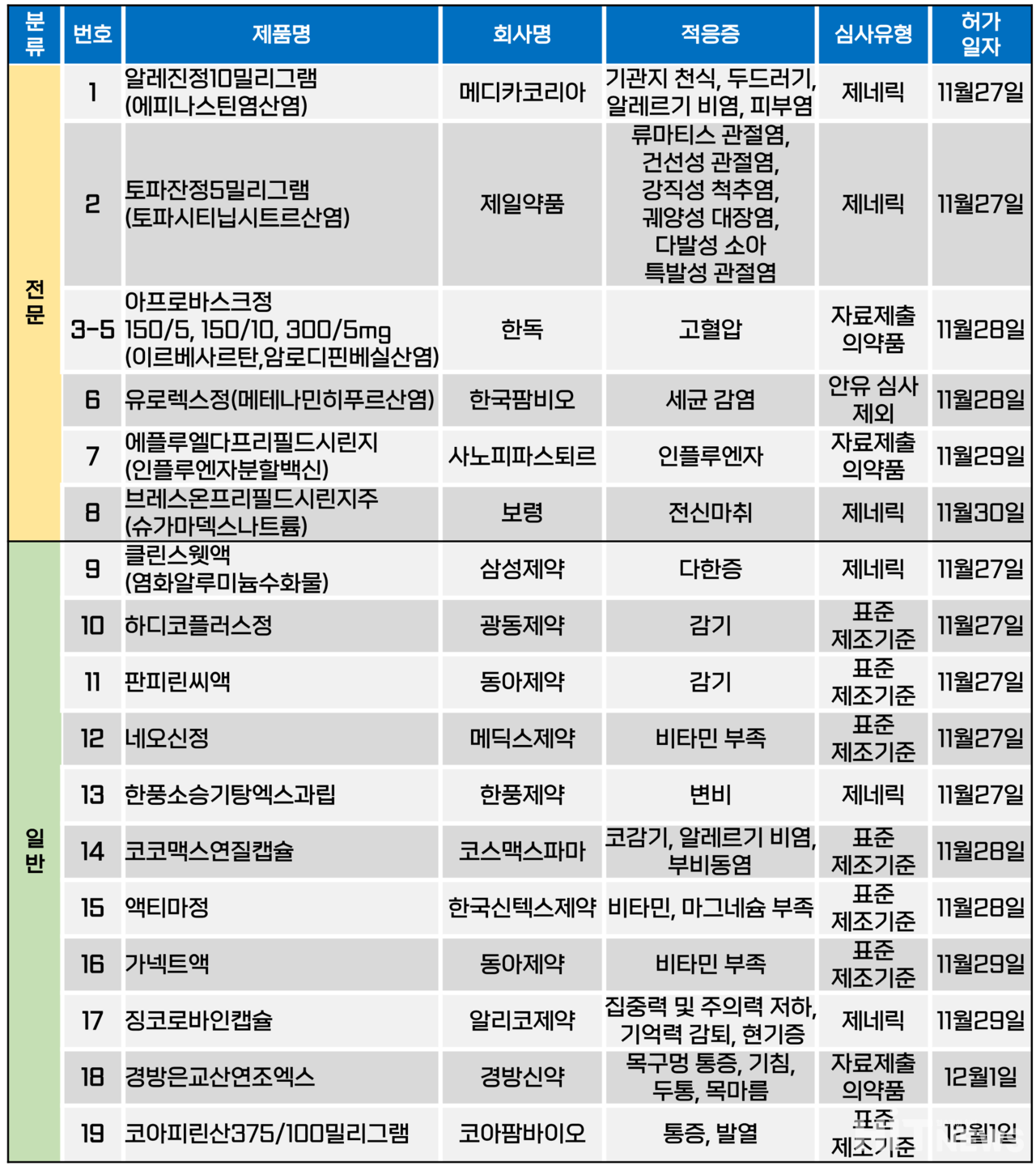
지난주(11월 27일~12월 1일) 총 19개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 8개 품목, 일반의약품은 11개 품목이었다. 이 의약품들은 기관지 천식, 알레르기 비염, 류머티즘 관절염, 궤양성 대장, 고혈압, 인플루엔자 질환 등 다양한 적응증으로 허가됐다.
사노피-파스퇴르(이하 사노피)는 자사가 개발한 인플루엔자 A형 및 B형 바이러스 감염에 의한 인플루엔자 질환 예방 백신 '에플루엘다 프리필드시린지(인플루엔자분할백신)'를 지난달 29일 허가받았다. 식약처는 이 의약품을 '65세 이상의 고령자에서 이 백신에 함유된 인플루엔자 A형 바이러스들 및 인플루엔자 B형 바이러스들에 의해 유발되는 인플루엔자 질환의 예방'을 적응증으로 허가했다.
에플루엘다는 인플루엔자 A형 바이러스주와 B형 바이러스주가 2개씩 포함된 4가 정제 불활화 백신이다. 의약품 내 포함된 바이러스 항원을 체내에 인식시켜, 면역반응을 유도한다. 이 백신은 유럽 및 브라질 시장에서는 에플루엘다라는 제품명으로 접종되고 있고, 미국과 캐나다 등 북미 시장에서는 '플루존 하이도즈 쿼드리밸리언트'라는 이름으로 공급되고 있다. 다만 접종 대상은 60세 혹은 65세로 차이가 있다.
최근 면역반응이 약한 65세 이상 고연령 환자에게 '고면역원성 백신'이 권고되고 있는데, 이 백신은 기존 제품 대비 항원 용량 또는 면역증강제를 추가한 것으로 정의된다. 에플루엘다는 이 중 항원 용량을 늘린 고면역원성 백신에 해당한다.
지난 8월 대한감염학회가 발표한 '2023년 성인 예방접종 개정안'에 따르면, 65세 이상 고령자에게는 고면역원성 백신인 △플루존 하이도즈 △플루아드 쿼드 △플루블록 쿼드 등 3개 제제를 권고하고 있다. 이 중 국내 허가된 제품은 플루아드 쿼드뿐이었지만, 이번 에플루엘다(플루존 하이도즈)의 허가로 총 2개가 됐다. 플루아드 쿼드의 경우, 일성신약이 지난 7월 글로벌 백신기업 CSL시퀴러스코리아(CSL Seqirus Korea)와 전략적 판매제휴 협약을 체결해 국내 공급하고 있다.
한편 국내 개발 4가 인플루엔자 백신을 보유한 회사로는 △SK바이오사이언스(스카이셀플루 4가 프리필드시린지) △GC녹십자(지씨플루쿼드리밸런트 프리필드시린지주) △보령바이오파마(보령플루Ⅴ테트라백신주) △일양약품(테라텍트 프리필드시린지주) △한국백신(코박스인플루4가PF주) 등이 있다. 이 중 SK바이오사이언스의 스카이셀플루 4가는 다른 백신들이 유정란 계대배양 방식을 사용한 것과 달리 세포배양 방식으로 생산, 계란 알레르기가 있는 환자들도 투여받을 수 있다는 장점이 있다.
임상시험계획은 총 26건이 승인됐다. 세부적으로 △1상 3건 △1b 3건 △1/2a상 1건 △2상 2건 △2a상 1건 △2b상 1건 △3상 9건 △생물학적동등성 4건 △연구자 임상 2건 등이다. 이 임상시험들은 고혈압, 이상지질혈증, 위식도 역류질환, 척수숨뇌근육위축증, 아토피성 피부염, 제2형 당뇨병, 파킨슨병, 급성 기관지염 등 질환과 불응성 B세포 급성 림프모구성 백혈병, 췌장암, 거세 저항성 전립선암, 비소세포폐암 등 암종을 대상으로 승인됐다.
미국 머크(MSD)가 개발 중인 전립선암 신약 후보물질 'MK-5684(개발코드명)'의 3상 임상시험계획이 지난 1일 승인됐다. 이번 3상 임상은 '이전에 차세대 호르몬성 제제(NHA)인 프레드니솔론과 탁산 제제 기반 화학요법으로 치료받은 이력이 있는 전이성 거세저항성 전립선암 환자'를 대상으로 MK-5684와 '자이티가(성분 아비라테론 아세테이트)' 및 '엑스탄디(성분 엔잘루타미드)'를 비교하는 무작위 배정, 라벨 공개 임상시험이다.
연구진은 1차 유효성 평가변수를 안드로겐 수용체(AR) 리간드 결합 도메인(LBD) 돌연변이 양성 참가자와 음성 참가자에서의 전체 생존기간(OS) 및 방사선학적 무진행 생존기간(rPFS)로 설정했다. 국내 30명 환자(글로벌 1200명)을 목표로 2029년 3월까지 임상을 진행할 예정이다. 임상 의료기관은 △서울대병원 △서울아산병원 △연세대 세브란스병원 △삼성서울병원 등이다.
한편 회사는 이 물질을 작년 7월부터 핀란드 제약회사인 '오리온코퍼레이션'과 공동으로 개발해 온 바 있다. 당시 오리온코퍼레이션은 'ODM-208'의 개발 및 상업화 협업 계약금으로 2억9000만달러를 초기 투자금으로 받았다. 현재 MK-5684라는 연구명으로 개발 중인 ODM-208은 CYP11A1 효소 활성을 억제함으로써 호르몬 의존성 암에서 안드로겐 수용체 신호 경로를 활성화시킬 수 있는 모든 스테로이드 호르몬과 전구물질 생성을 억제하도록 만들어졌다.
당초 MSD는 자사 면역항암제인 '키트루다(성분 펨브롤리주맙)'와 MK-5684를 전이성 거세저항성 전립선암 치료제로 개발 중이었다. 다만 지난 3월 이 질환을 대상으로 키트루다와 엑스탄디 및 안드로겐 차단요법(ADT) 병용요법을 비교한 임상 3상 연구인 'KEYNOTE-641' 시험을 중단한다고 밝혔다. 회사는 그 이전인 올해 1월에도 전이성 호르몬반응성 전립선암 환자를 대상으로 한 임상 3상인 'KEYNOTE-991'의 실패를 밝힌 바 있다.
전립선암을 대상으로 한 면역항암제의 임상 실패가 이어지고 있는 가운데, 향후 이 질환을 타깃으로 한 표적항암제의 임상 결과들은 어떻게 이어질 지 주목된다.