로슈, 캐나다 '리페어'서 도입한 '카몬세르티브', 전립선암 대상 1상 승인
로슈, 캐나다 '리페어'서 도입한 '카몬세르티브', 전립선암 대상 1상 승인
[허가/임상] 투여기간 28→21일 단축한 여성호르몬제 '크리멘' 허가
- 기자명 황재선 기자
기존 '크리멘28정' 대비 투약 기간 감소, 골다공증 예방 적응증 추가
로슈, 캐나다 '리페어'서 도입한 '카몬세르티브', 전립선암 대상 1상 승인
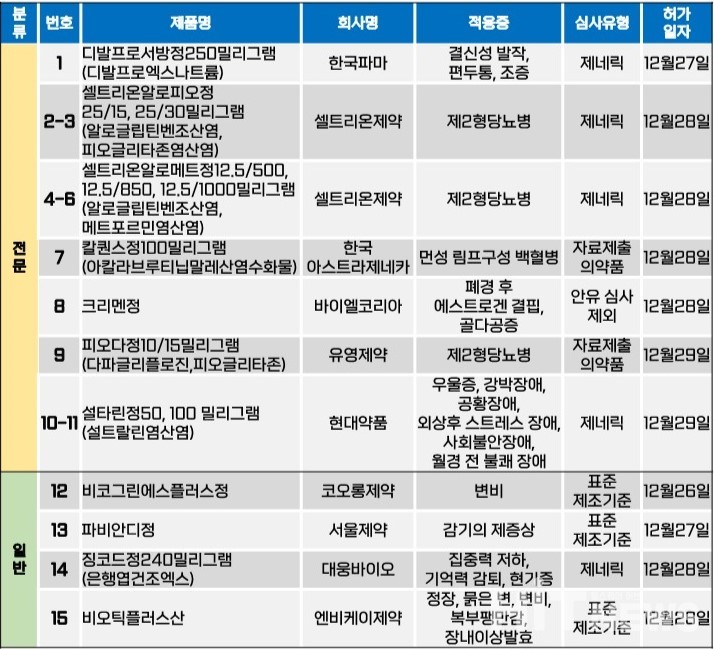
지난주(12월 25~29일) 총 15개 품목이 식품의약품안전처로부터 품목허가를 받았다. 전문의약품은 11개 품목, 일반의약품은 4개 품목이었다. 이 의약품들은 결신성 발작, 편두통, 제2형 당뇨병, 만성 림프구성 백혈병, 에스트로겐 결핍, 우울증 등 다양한 적응증으로 허가됐다.
바이엘이 개발한 호르몬대체요법제(HRT) '크리멘정(성분 에스트라디올 발레레이트(미분화)+시프로테론아세테이트(미분화))'이 지난달 28일 허가됐다. 크리멘정은 기존 바이엘이 국내에 출시하고 있던 '크리멘28정(성분 에스트라디올 발레레이트+시프로테론아세테이트)'의 투여 기간을 단축시키고, 골다공증 예방 적응증을 추가시킨 제제다.
식약처에 따르면, 크리멘정은 △폐경 후(마지막 생리 후 최소 1년이 경과된 시점) 여성의 에스트로겐 결핍의 증상 경감을 위한 호르몬대체요법 △골절의 위험이 있는 폐경 후 여성의 골다공증 예방 등을 적응증으로 허가됐다.
크리멘정과 크리멘28정의 가장 큰 차이는 투여 기간의 변화다. 크리멘28정은 1일 1정씩 28일간 복용하도록 허가돼 있다. 초반 16일간은 흰색 정제를 복용하고, 다음 12일간은 분홍색 정제를 복용하면 된다. 이후 계속 복용을 희망하는 경우, 새 제품을 다시 1일차부터 복용하면 된다.
반면, 크리멘정은 투약 기간을 21일로 단축했다. 처음 11일 동안은 흰색 정제 1개를 매일 복용하고, 이후 10일 동안은 분홍색 정제 1개를 매일 복용하면 된다. 이후 계속 복용을 희망한다면, 7일간 휴약 후 새 제품을 다시 1일차부터 복용하면 된다. 이외에도 크리멘28정과 달리 '골절의 위험이 있는 폐경 후 여성의 골다공증 예방'을 목적으로 사용할 수 있게 허가됨으로써 사용 환자군을 넓힌 것이 특징이다.
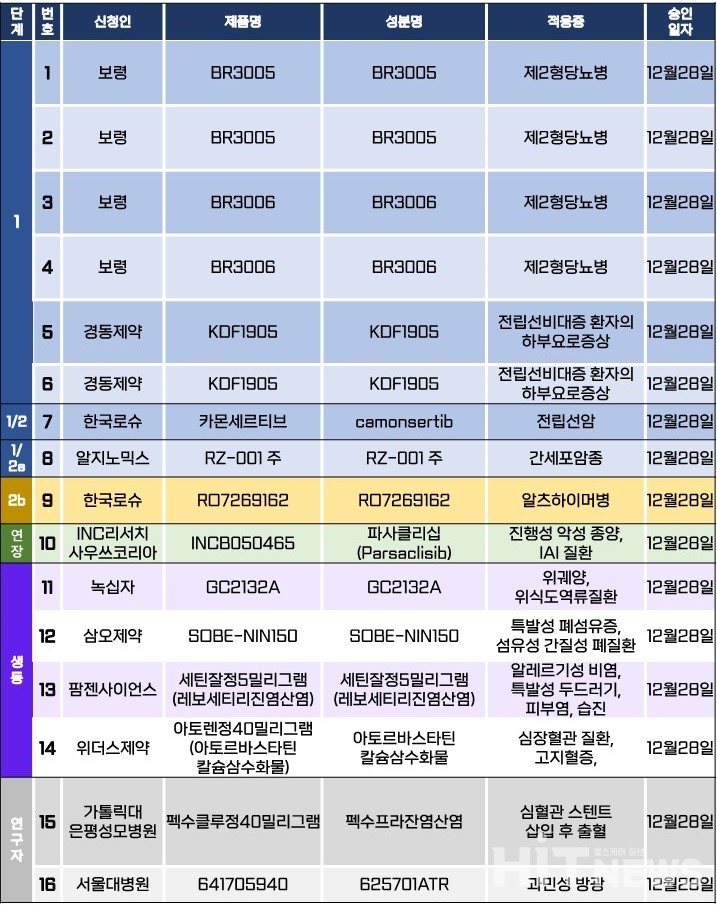
지난주 임상시험계획은 총 16건이 승인됐다. 세부적으로 △1상 6건 △1/2상 1건 △1/2a상 1건 △2b상 1건 △연장 1건 △생물학적 동등성 4건 △연구자 임상 2건 등이다. 이 임상시험들은 제2형 당뇨병, 전립선 비대증 환자의 하부요로증상, 알츠하이머병, 위궤양, 알레르기성 비염 등 질환과 전립선암, 간세포암종 등 암종을 대상으로 승인됐다.
로슈가 개발 중인 고형암 치료제 후보물질 '카몬세르티브(Camonsertib)'의 전립선암 대상 1/2상 임상시험계획이 지난달 28일 승인됐다. 해당 임상시험계획에 따르면, 이번 임상은 '전이성 거세 저항성 전립선암 환자'를 대상으로 새로운 요법(연구명 (CO44747)) 또는 '다로루타마이드(제품명 뉴베카정)'와의 병용요법(연구명 CO45108)의 안전성, 약동학, 유효성을 평가하는 제1b/2상 플랫폼 시험(연구명 (CO44747))이다. 목표 환자수는 7명(글로벌 45명)이다. 오는 2030년 12월 종료를 목표로 △서울대병원 △서울아산병원 등 의료기관에서 진행된다.
연구진은 이번 임상의 1차 유효성 평가변수(Primary endpoint)를 △투여 후 발생 이상사례 및 실험실 검사수치 이상의 발생률, 속성, 중증도(NCI CTCAE v5.0에 따라 평가) △내약성(전반적 요법 노출 및 용량 조정 발생률로 평가) △DLT 발생률 및 속성 등으로 설정했다. 또 2차 유효성 평가변수(Secondary endpoint)로 △복합 반응률(확인된 PSA50 반응, 확인된 CR 또는 PR) △rPFS(방사선학적 무진행 생존기간) △PSA(전립선 특이항원) 진행까지의 시간 △OS(전체 생존율) 등으로 설정했다.
한편, 이번에 국내 첫 임상을 진행하는 카몬세르티브는 로슈가 캐나다 바이오 기업인 '리페어테라퓨틱스(Repare Therapeutics)'로부터 2022년 6월 기술도입한 물질이다. 카몬세르티브는 종양세포의 ATM(Ataxia-Telangiectasia mutated kinase) 및 ATR(Ataxia-Telangiectasia & Rad3-related protein kinase) 유전자 변이를 타깃하는 경구용 억제제다.
당시 로슈는 리페어 측에 1억2500만달러를 선지급하고, 단기간에 지불될 수 있는 5500만달러 등을 포함한 임상, 허가, 상업화, 영업 등에 따른 마일스톤을 최대 12억달러로 설정한 바 있다. 뿐만 아니라, 글로벌 매출 성과에 따라 수십 퍼센트(%)의 로열티까지 부여할 수 있도록 했다.